质粒转染技术作为分子生物学领域中的一项重要技术,已经广泛应用于基因表达、基因治疗、疫苗研发等多个领域。其基本原理是通过将外源DNA(通常是质粒)导入目标细胞,实现基因的表达和功能研究。
质粒,通常是小型的环状DNA分子,能够在细胞内独立复制。质粒具有携带基因的能力,这使得其成为基因转染中理想的载体。与病毒载体相比,质粒转染技术因其操作简便、安全性高而受到广泛应用。
质粒转染的核心原理是利用物理或化学手段打破细胞膜的屏障,将质粒DNA成功导入细胞内。细胞一旦接受到质粒,质粒中的基因就会在细胞内进行转录和翻译,最终产生相应的蛋白质,这一过程是基因功能研究的基础。
目前,质粒转染的方法主要有化学法、电转法、病毒法等。每种方法都有其独特的优势,能够根据不同的实验需求选择适合的转染策略。
化学法转染通过利用一些阳离子试剂(如脂质体)与DNA结合,形成脂质体-DNA复合物,从而使得质粒能够通过细胞膜进入细胞。电转法则是通过电场的作用,使得细胞膜局部产生微小孔隙,允许DNA进入细胞。病毒法则通过使用病毒载体来转导质粒DNA,通常用于高效的转染。
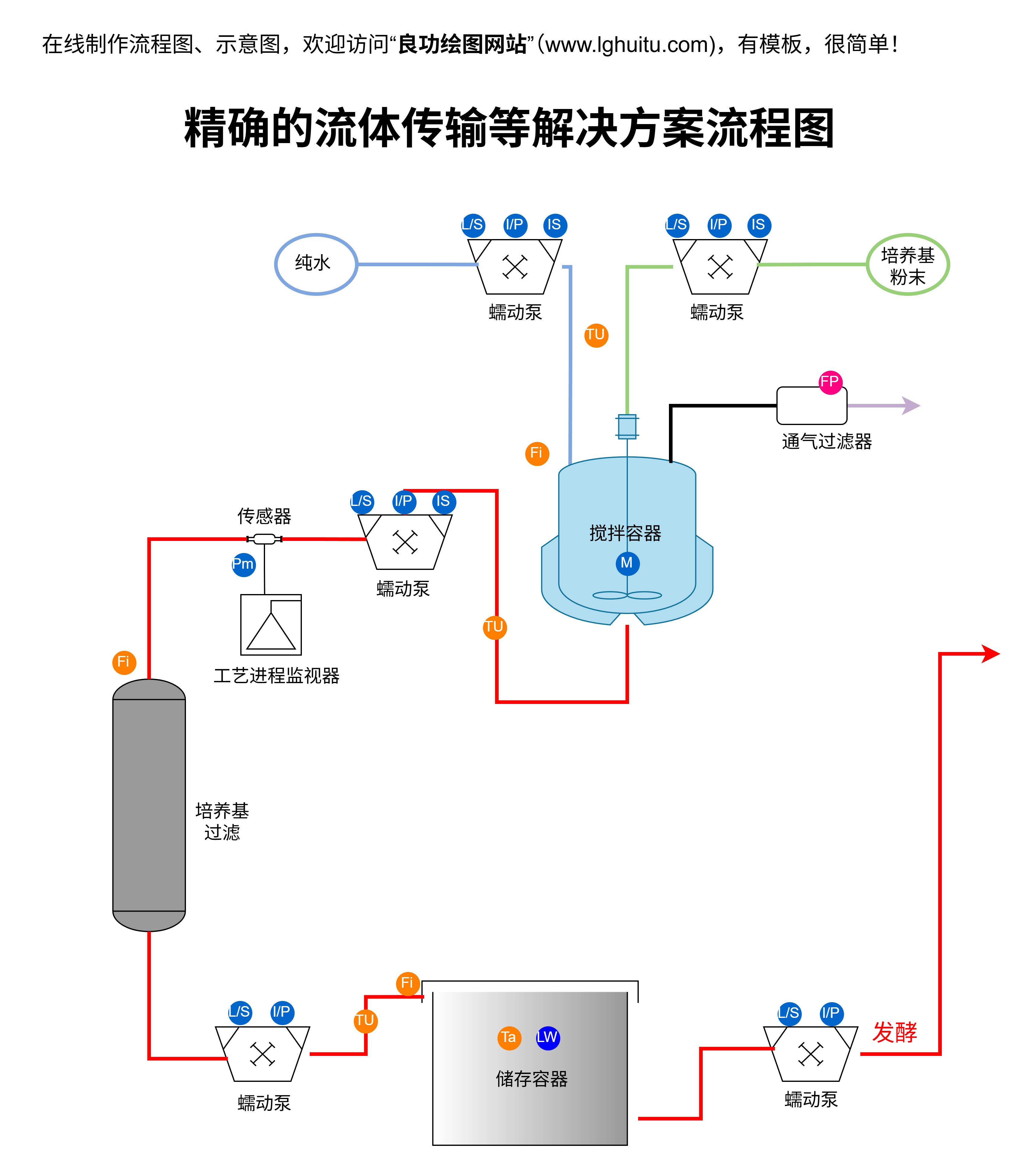
无论使用哪种方法,质粒转染的最终目标都是让外源基因能够在细胞内稳定表达,这样科学家们便可以对基因的功能、机制以及相关疾病的研究进行深入探索。
为何质粒转染技术如此重要?它为基因治疗提供了重要的工具。通过将治疗性基因导入患者细胞,科学家们能够修复或替代受损基因,从而为治疗遗传性疾病开辟了新的可能。质粒转染技术在疫苗研发中也发挥着重要作用。通过将病毒基因导入宿主细胞,科学家可以研发出新型的疫苗,这对于应对流行性疾病尤为重要。
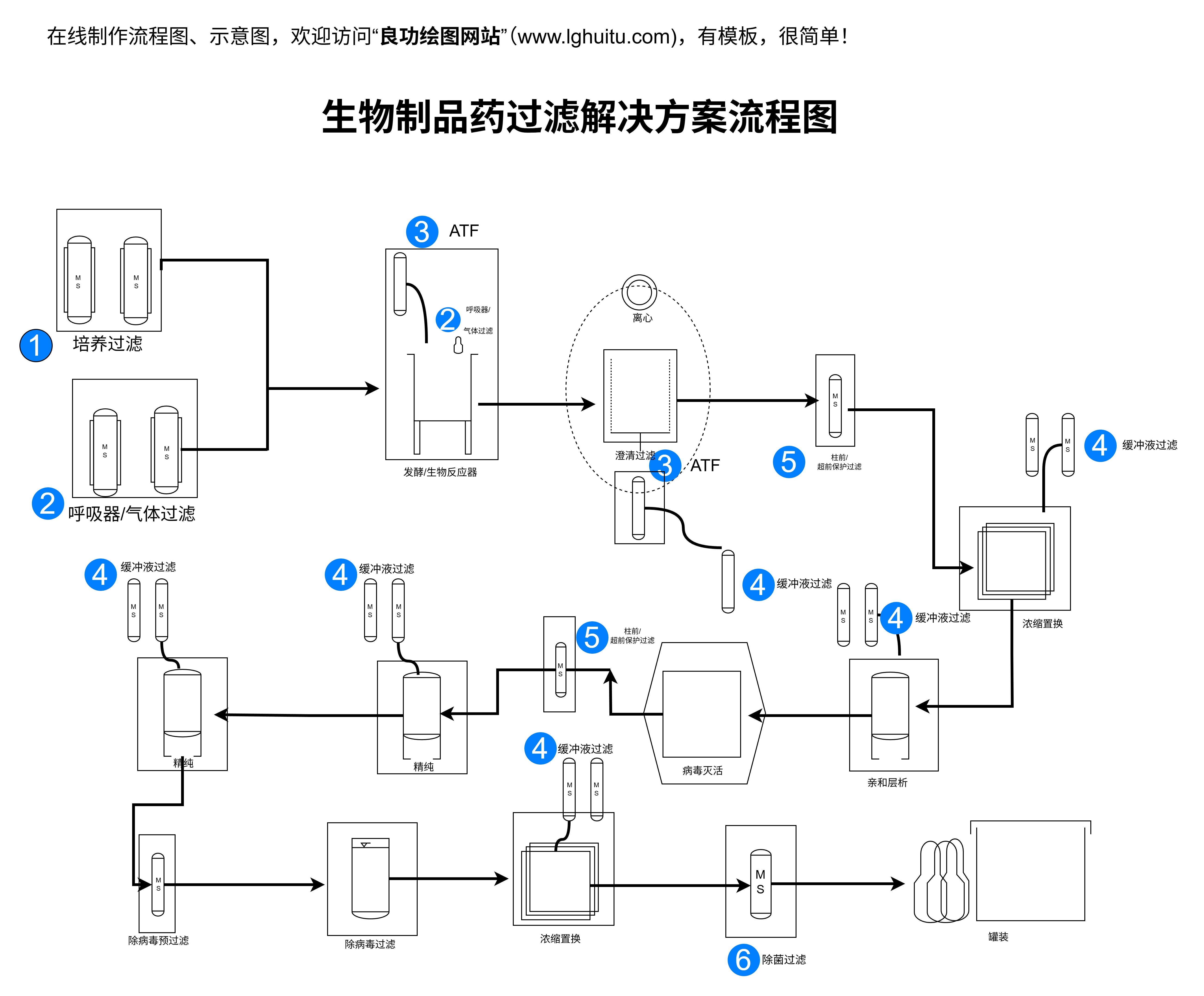
质粒转染不仅为基础研究提供了强有力的工具,还为疾病治疗提供了希望。在日益深入的基因组学研究中,质粒转染技术无疑是打开基因奥秘的一把钥匙。
质粒转染的成功与否直接取决于实验的操作步骤和所选用的转染方法。为了确保转染效率,研究人员需要严格按照步骤进行操作,并优化每一个环节。
质粒转染的第一步是准备质粒DNA。选择适合实验的质粒,并确保其纯度足够高。一般来说,纯化的质粒DNA必须达到一定的浓度,才能确保转染的效率。常用的质粒纯化方法包括酚-氯仿法和柱纯化法。
在DNA纯化的过程中,需要避免任何可能导致DNA降解的因素,如过高的温度或不适当的存储条件。纯化后的质粒DNA应在低温下存储,避免反复冻融。
研究人员需要选择合适的细胞系进行转染。不同类型的细胞对转染的敏感性不同,因此选择合适的细胞系至关重要。常见的细胞系包括HEK293、COS-7和CHO细胞等。
在进行质粒转染前,细胞需处于对数生长期,且细胞状态良好。为了提高转染效率,细胞密度要适中,通常保持在70%-80%的融合度为最佳。
根据所选用的转染方法,选择合适的转染试剂是成功的关键。例如,化学法转染中常用的转染试剂有脂质体(如Lipofectamine、Fugene等)。这些试剂能与质粒DNA形成复合物,帮助DNA穿越细胞膜。
在选择转染试剂时,研究人员应根据细胞类型、转染效率以及毒性等方面综合考虑。不同的转染试剂具有不同的转染效果,因此需要通过实验来选择最适合的转染试剂。
质粒DNA和转染试剂的配比需要根据所选用的转染方法来确定。以脂质体法为例,通常需要将转染试剂与质粒DNA在无血清培养基中混合,待形成复合物后再添加到细胞中。转染试剂与质粒DNA的结合要保证均匀,避免因复合物不稳定而影响转染效率。
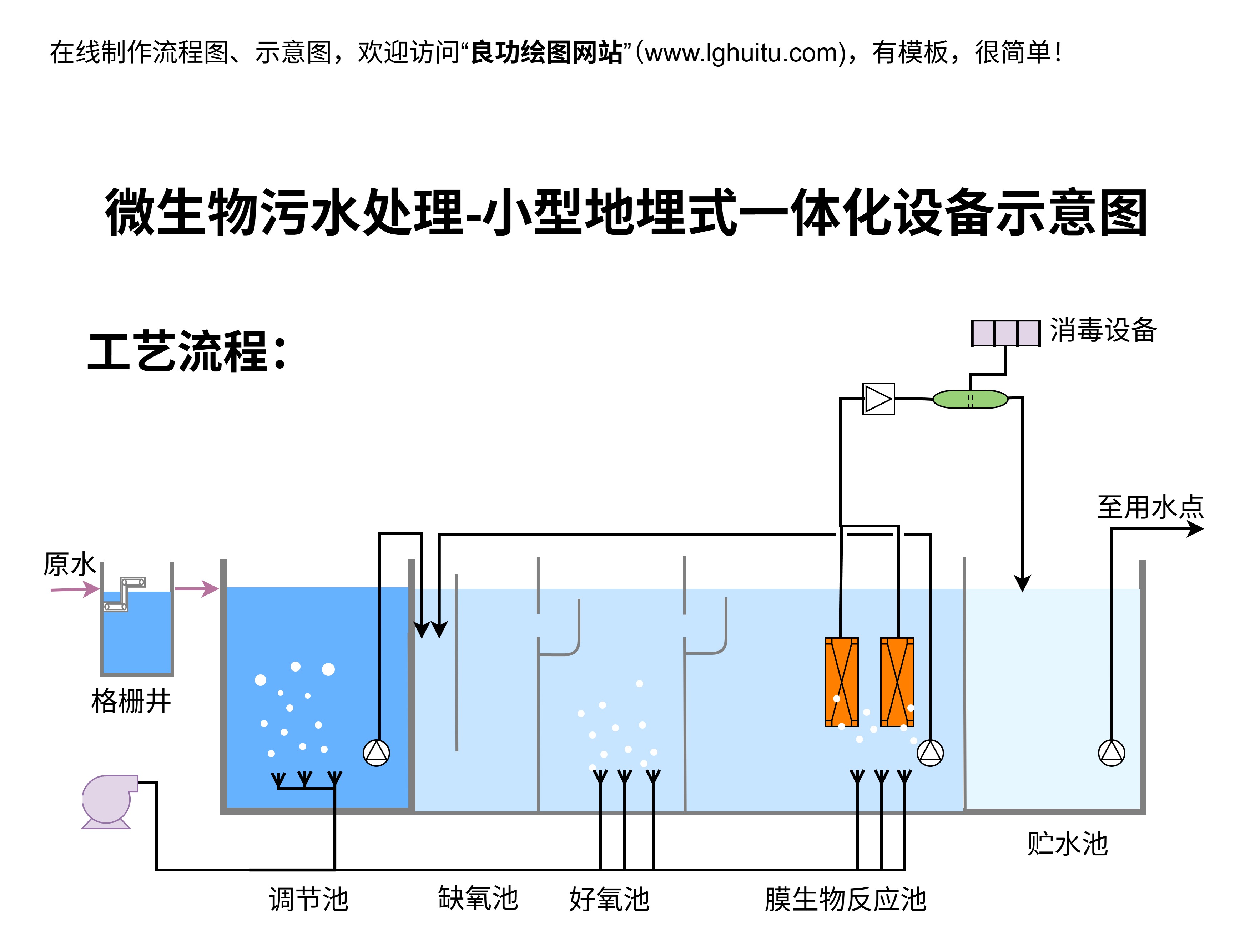
转染后,细胞通常需要在37℃、5%CO₂的条件下培养24-48小时,给予足够的时间让外源基因表达。根据实验的需要,研究人员可以通过添加抗生素来筛选成功转染的细胞。
在转染后,研究人员可以通过荧光显微镜、Westernblot等技术来检测质粒转染的效果。如果质粒携带有荧光标记基因,可以直接通过荧光显微镜观察细胞内的荧光信号,从而判断转染效率。
如果质粒携带有报告基因,如GFP或Luciferase等,也可以通过相应的检测方法来评估转染效果。研究人员还可以通过RT-PCR、Westernblot等技术检测目标基因的表达情况,以确保基因能够在细胞中成功表达。
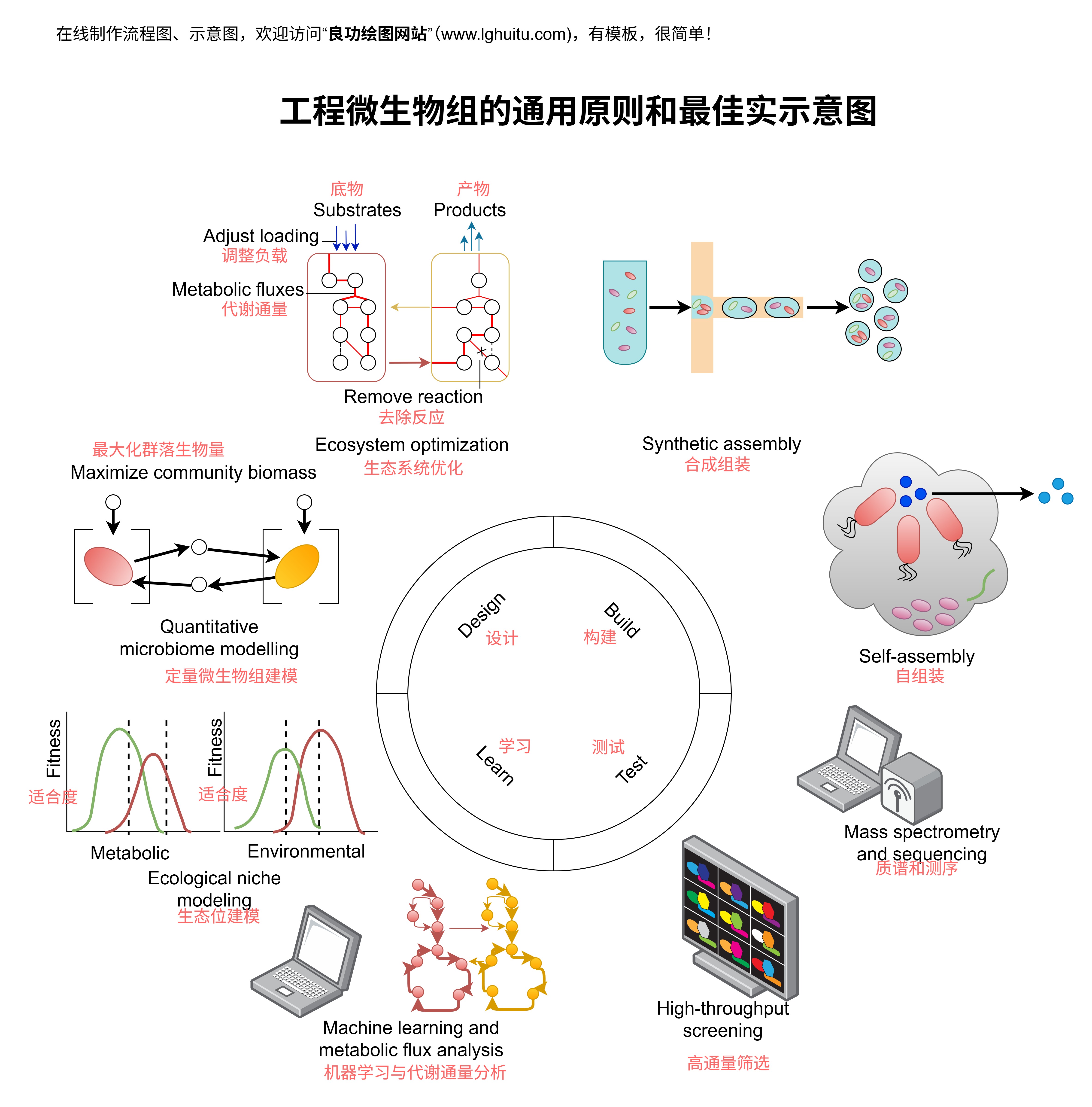
总结而言,质粒转染的成功不仅依赖于细致的步骤操作,还需要针对不同细胞系、不同质粒载体、不同转染试剂等因素进行优化。通过不断调整和改进,研究人员能够提高转染效率,实现基因表达的最大化。
质粒转染技术在现代分子生物学中占据着不可替代的地位,随着技术的不断进步,其在基因治疗、疫苗研发、癌症研究等领域的应用前景更加广阔。