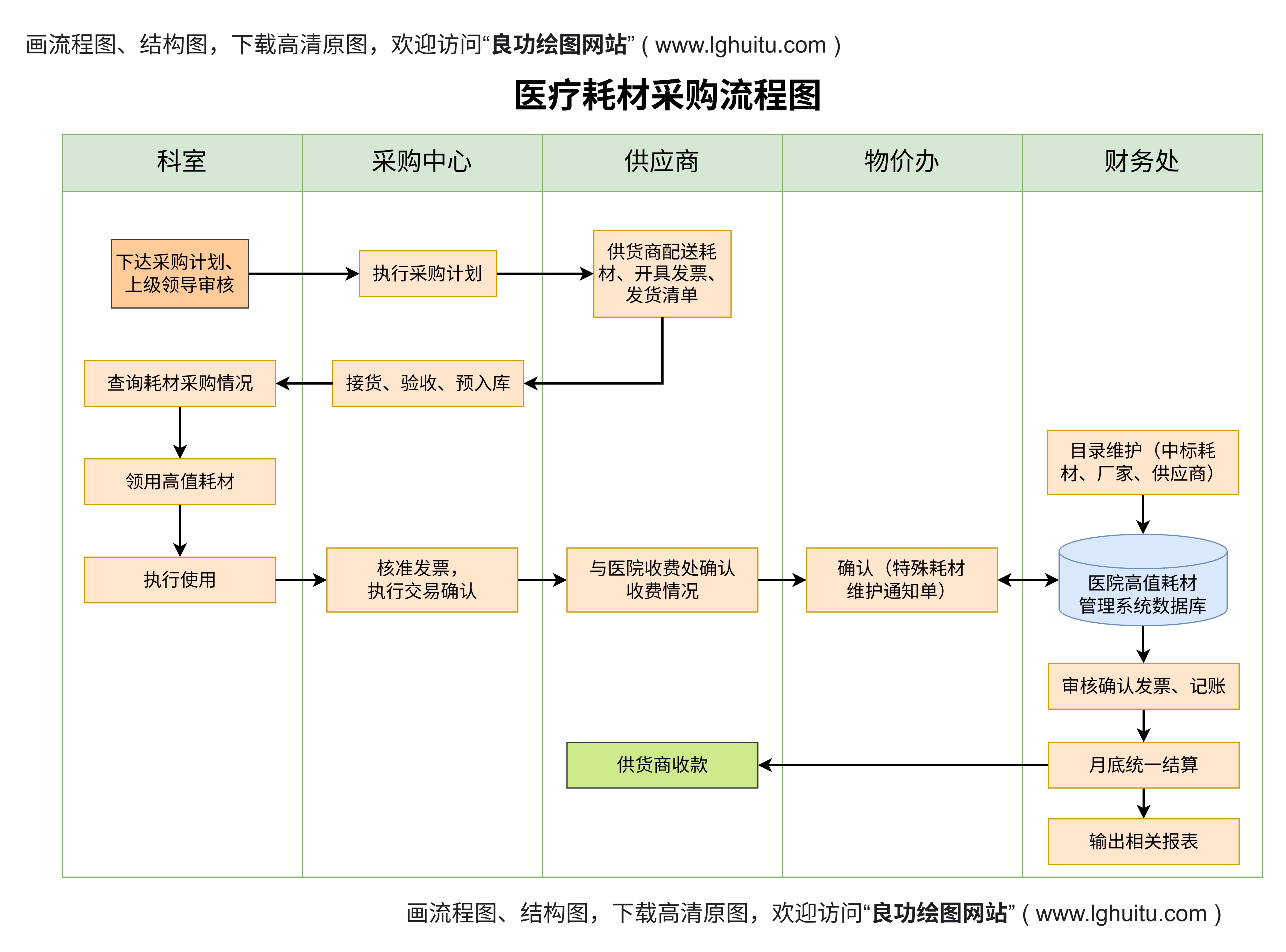
在中国,医疗器械的管理严格而有序,医疗器械经营许可证作为企业进入市场的必要条件,尤其对于不同类别的器械,国家有着不同的监管要求和审批流程。了解一二三类医疗器械经营许可证的区别,是每个从事医疗器械行业的企业都应当掌握的知识。今天,我们就来深入分析这三类医疗器械经营许可证的差异,帮助您更好地理解它们的申请要求和市场定位。

一类医疗器械是指对人体危害较小、使用过程中的安全风险较低的医疗器械。这类器械通常不需要进行复杂的审批过程,也不需要特别的技术要求。比如,常见的一类医疗器械有体温计、绷带、棉签等,这些设备的使用相对简单,对人体健康的威胁较小。

一类医疗器械经营许可证的申请条件相对宽松,主要要求企业具备基本的运营能力和合法的经营场所。申请流程中,企业需要提交相关的企业资质文件,进行备案登记,并确保其经营的产品符合国家的基础标准。这类许可证的审批过程较快,且监管相对宽松,企业在取得许可证后,通常只需定期进行自我检查,确保产品的质量与安全。

与一类医疗器械不同,二类医疗器械是指对人体有一定风险,但使用时能够通过合理控制风险确保安全的医疗器械。二类器械通常涉及到一些对人体有一定影响的设备,如血糖仪、超声波诊断仪等,这类产品的使用和管理需要更为严格的监督。
因此,二类医疗器械经营许可证的申请条件和审批要求要高于一类。申请企业需要提交详细的产品注册文件和生产厂商的资质证明。企业需要具备一定的质量管理体系,如GMP认证(良好生产规范)或ISO质量管理体系认证。企业还需建立完善的售后服务体系和产品追溯系统,确保产品质量问题能够得到及时解决。

二类医疗器械的许可证审批过程较为复杂,通常需要通过技术审查和现场检查。企业在取得许可证后,还需要遵守更为严格的管理规定,如定期进行质量检验和产品备案。这些监管要求确保了二类医疗器械产品的质量和安全,为消费者提供了更多保障。
三类医疗器械是指对人体具有较高风险的医疗器械,且其使用不当可能会对生命和健康造成严重危害。常见的三类医疗器械包括心脏起搏器、人工关节、植入式医疗器械等,这些器械不仅要求高精度的制造工艺,还需要复杂的技术支持和严格的质量控制。
因此,三类医疗器械经营许可证的申请和管理要求最为严格。申请企业必须提供详细的产品设计和技术文档,证明其产品符合国家和国际的安全标准。企业必须具备高水平的生产设施和技术支持团队,确保产品在设计、制造和售后各个环节的高质量控制。
三类医疗器械的审批流程通常会涉及到多轮技术审查和现场检查,监管部门对产品的生产环境、质量管理体系等方面进行严格审查。取得三类医疗器械经营许可证后,企业还需要定期向监管部门报告产品的使用情况和安全性,确保产品的长期稳定性和可靠性。
通过上述分析,我们可以看出,一二三类医疗器械经营许可证在申请要求、审批流程、监管标准等方面有着显著的差异。具体来说:
申请难度与审批流程:一类医疗器械的申请难度相对较低,企业只需进行备案登记;二类医疗器械的审批较为严格,企业需要提交更多的注册文件,并且可能需要接受技术审查;三类医疗器械则是最为复杂的一类,申请企业不仅要提交详细的技术文档,还要通过多轮审查。
产品的风险控制要求:一类医疗器械的产品风险相对较小,管理要求较为宽松;二类医疗器械则需要企业具备较强的质量管理体系,确保产品的安全性;三类医疗器械的产品风险较高,因此要求企业具备更加严密的技术保障和质量控制体系。
市场定位与影响:一类医疗器械多为日常生活中常见的基础性器械,市场竞争相对宽松;二类医疗器械的产品往往具有一定的技术要求,市场需求较大,竞争激烈;三类医疗器械的产品往往面向高端市场,技术门槛高,产品价格也较为昂贵,竞争相对较小。
企业在选择申请哪一类医疗器械经营许可证时,首先需要根据自身经营的产品类型和市场需求来决定。如果您经营的是基础性、风险较低的医疗器械,申请一类医疗器械经营许可证即可。如果您的产品属于具有一定风险的器械,且市场需求较大,申请二类医疗器械经营许可证是一个较好的选择。而如果您从事的是高风险、高技术含量的医疗器械,申请三类医疗器械经营许可证将是最为合适的路径。
了解一二三类医疗器械经营许可证的区别,不仅有助于企业选择合适的经营方式,还能在激烈的市场竞争中占据有利位置。在申请过程中,企业必须严格遵守相关法律法规,确保产品的质量和安全,才能获得消费者的信任与认可。
通过合理的许可证选择和完善的管理体系,您的企业将能够在医疗器械行业中立足,拓展市场,获得更大的发展空间。