近年来,随着我国医疗行业的快速发展,医疗器械的种类、数量不断增加,给医疗安全带来了前所未有的挑战。特别是在医疗器械的监管方面,传统的管理方式逐渐暴露出许多问题:信息传递不及时、追溯困难、质量监管不完善等。这些问题不仅影响了医疗器械的使用效率,更重要的是可能带来安全隐患,危及患者生命健康。

为了应对这一挑战,国家药品监督管理局(NMPA)推出了医疗器械唯一标识制度(UDI),这项制度的实施标志着我国医疗器械管理进入了一个全新的阶段。UDI制度的核心理念是通过赋予每一件医疗器械一个独特的标识,使其在整个生命周期内都能够被准确追溯。这种标识通常由数字和字母组成,涵盖了设备的生产商信息、型号、生产批次等关键数据。

通过UDI制度,监管部门能够更加高效地监控医疗器械的使用情况。对于消费者和医疗机构而言,UDI不仅提高了医疗器械的使用安全性,也加强了产品质量的透明度。UDI制度还促进了医疗器械信息化建设,使得设备管理更加规范、便捷,为医疗行业的智能化转型铺平了道路。
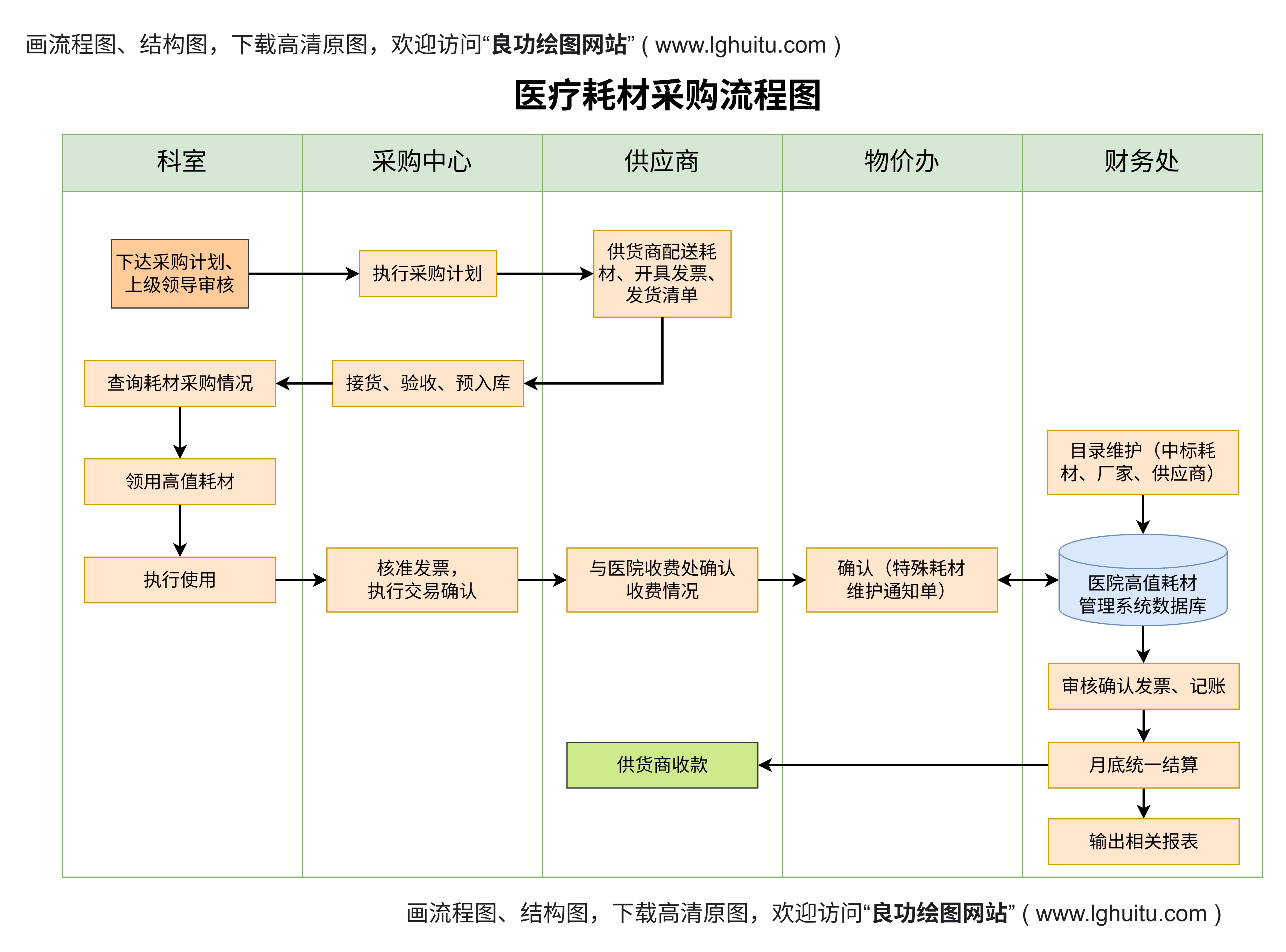
医疗器械唯一标识制度的实施,不仅能够强化医疗器械的质量管理,还能为医疗行业的创新与发展提供强有力的支持。随着信息技术的不断进步,UDI制度将进一步实现与大数据、人工智能等技术的结合,从而提升医疗器械的安全性、可追溯性以及智能化水平。

随着医疗器械唯一标识制度(UDI)的深入实施,未来该制度将为我国医疗器械行业带来更为深远的变革。UDI制度为产品质量追溯提供了坚实的基础。在传统的监管模式下,许多医疗器械的生产与流通信息并不透明,且缺乏有效的追溯系统,这给突发的医疗安全事件处理带来了巨大的困难。而在UDI制度下,每一件医疗器械都拥有独立的标识信息,监管部门可以随时追溯产品的来源与使用情况,一旦出现质量问题,可以快速锁定问题产品并进行召回,减少安全事故的发生。

UDI将成为推动医疗器械数字化转型的重要力量。随着互联网和物联网技术的快速发展,医疗器械行业正在经历一场信息化革命。未来,医疗器械的生产、销售、使用等环节将越来越依赖数字化系统,而UDI制度正是这一变革的重要组成部分。通过将医疗器械的唯一标识与各类信息系统对接,医院和监管机构可以实时监控医疗器械的使用情况,进一步提高医疗服务的效率和安全性。
UDI制度的实施也面临一些挑战。由于医疗器械种类繁多,且许多医疗器械的生产工艺和使用场景复杂,如何确保每一件医疗器械都能够准确、快速地获得唯一标识,是一个巨大的技术难题。国内外医疗器械生产企业的标准和执行力度不一,部分小型企业可能面临技术和资金的双重压力,导致UDI标识的实施进度不均衡。因此,加强政策引导和技术支持,推动全行业协同发展,将是确保UDI制度顺利实施的关键。
尽管如此,随着相关政策和技术的不断完善,医疗器械唯一标识制度无疑将在未来发挥更加重要的作用。通过这一制度的推动,我国医疗器械行业的管理水平、产品质量、信息透明度等都将迎来质的飞跃。最终,UDI制度的全面普及将为患者提供更为安全、有效的医疗服务,为整个社会的健康事业贡献力量。