在药物研发的过程中,临床试验是关键的一环。它不仅关系到新药的安全性和有效性,更为重要的是,它为我们揭示了药物是否能够进入市场,成为患者的福音。而每一阶段的临床试验都有其独特的重要性和要求。我们今天要深入探讨的是:一二三四期临床试验的病例数,如何影响整个药物研发的进程。
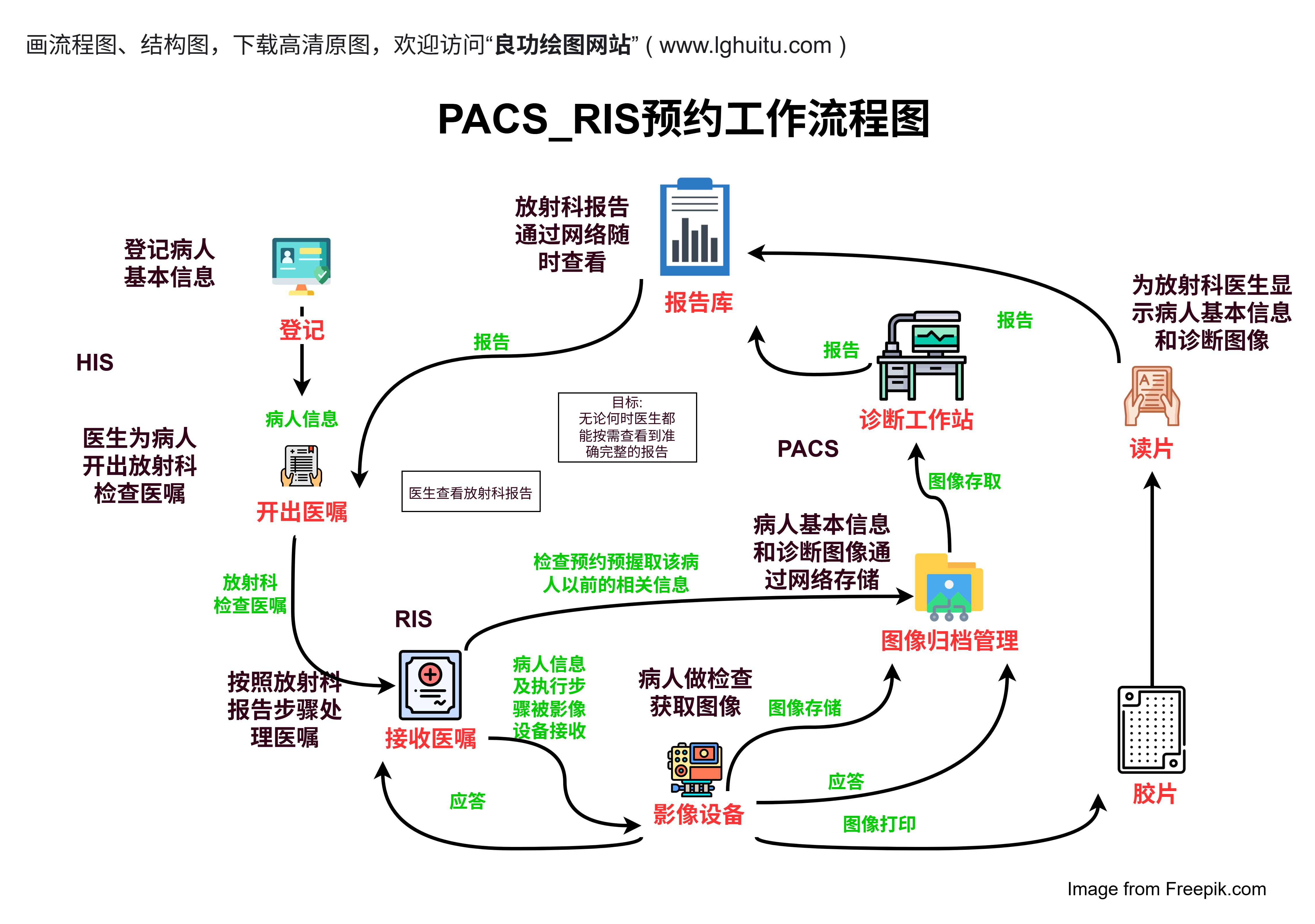
一期临床试验通常是药物研发的第一步,它的主要目标是评估新药的安全性、药代动力学(如何在体内吸收、分布、代谢和排泄)以及是否有严重的副作用。此阶段的临床试验通常是在健康志愿者中进行,病例数相对较少,一般在20到100人之间。由于参与者健康状况良好,这一阶段的试验主要关注药物的耐受性及其对人体的影响。

虽然一期试验的病例数较少,但这一阶段的数据极为重要。它帮助研究人员筛选出不适合继续开发的药物,从而有效避免不必要的资源浪费。如果一期临床试验发现药物的副作用过于严重,或者药代动力学表现不符合预期,那么该药物就可能会被终止开发。

尽管一期试验的病例数较少,但它为后续的临床试验奠定了基础。通过这阶段的数据,研究人员能够为二期试验的设计提供科学依据,确保药物在更大范围内的临床应用能够顺利进行。
二期临床试验的主要目标是评估药物的疗效以及进一步确认其安全性。在这一阶段,试验的规模有所扩大,通常会涉及100到500名患者。这些患者通常是针对药物所治疗的特定疾病人群,例如某种癌症患者、糖尿病患者或高血压患者。

二期试验不仅关注药物的安全性,还开始着重评估药物的治疗效果。这一阶段的病例数增加了,试验的对象也开始转向真实的病人群体,而非健康志愿者。通过这些数据,研究人员能够更深入地了解药物的治疗效果及其在不同病人群体中的表现。
如果二期试验的结果显示药物有效并且安全,研发团队便可以进入下一阶段的临床试验,即三期临床试验。这时,药物的临床价值会被更加清晰地呈现,而病例数的增加也为药物的临床疗效提供了更为坚实的证据。
三期临床试验是临床试验中最为关键的一阶段,它直接决定了药物是否能够上市。三期试验的病例数通常非常庞大,往往需要几千到几万名患者参与。这一阶段的试验不仅要求药物具有显著的疗效,还需要在更大规模的患者群体中验证药物的安全性。
在三期试验中,患者群体的多样性增加,涵盖了不同年龄、性别、种族、病程等多种因素。通过对大量病例的观察,研究人员能够评估药物在不同患者群体中的效果和副作用情况。这些数据不仅为药品监管部门提供了详细的安全性和有效性报告,也为药物上市后的使用提供了科学依据。
三期临床试验通常是与对照组进行比较,确保药物的疗效优于现有的治疗方法。患者群体的增加,不仅增加了数据的代表性,还为药物的长期安全性评估提供了重要支持。
四期临床试验是药物上市后的阶段,主要目的是对药物进行持续的安全性和有效性监测。这一阶段的病例数可能比三期更为庞大,因为此时药物已经进入广泛的市场应用,参与者的数量几乎没有上限。四期试验的重点是通过收集大量的实际使用数据,确保药物在长期使用中的效果和安全性。
在四期临床试验中,研究的焦点逐渐转向药物在日常医疗中的应用情况,可能会涉及到不同疾病的并发症、药物相互作用、长期副作用等方面。这些信息对医生、患者和监管机构都是至关重要的,可以为药物的长期使用提供科学支持。
四期试验的病例数常常依赖于药物的普及程度和使用情况,尤其是在全球范围内,患者的数量可以达到极其庞大的规模。通过对这些数据的分析,研究人员能够及时发现药物使用中的潜在问题,从而进行调整和改进,确保药物能够持续为患者提供安全有效的治疗。
通过上述分析,我们可以看到,临床试验的每个阶段都对应着不同数量的病例,随着试验阶段的推进,病例数逐渐增加。这是因为随着药物研发的深入,研究人员需要更为广泛的数据支持,以验证药物的疗效与安全性。
一期到四期的临床试验,不仅在病例数上有显著差异,更在研究重点、目标群体和数据分析方式上有所不同。每个阶段的临床试验都为药物的上市提供了坚实的科学依据,而临床试验中的病例数则直接影响了药物的研发进程。
从一个更广泛的视角来看,临床试验的病例数越多,药物研发所面临的挑战和风险也越大。因此,研发团队不仅要充分考虑试验的规模和病例数,还要精心设计每个阶段的临床试验,以确保药物能够安全有效地服务于广大患者。
临床试验的不同阶段和不同病例数,不仅是药物研发过程中不可或缺的步骤,更是确保药物能够安全、高效地应用于患者的关键。随着科学技术的不断进步,临床试验的设计和执行将变得更加精准,病例数的选择也将更加符合实际需求。在未来,随着更多新药的诞生,我们有理由相信,临床试验的病例数将不断创新,推动全球医疗健康事业的蓬勃发展。