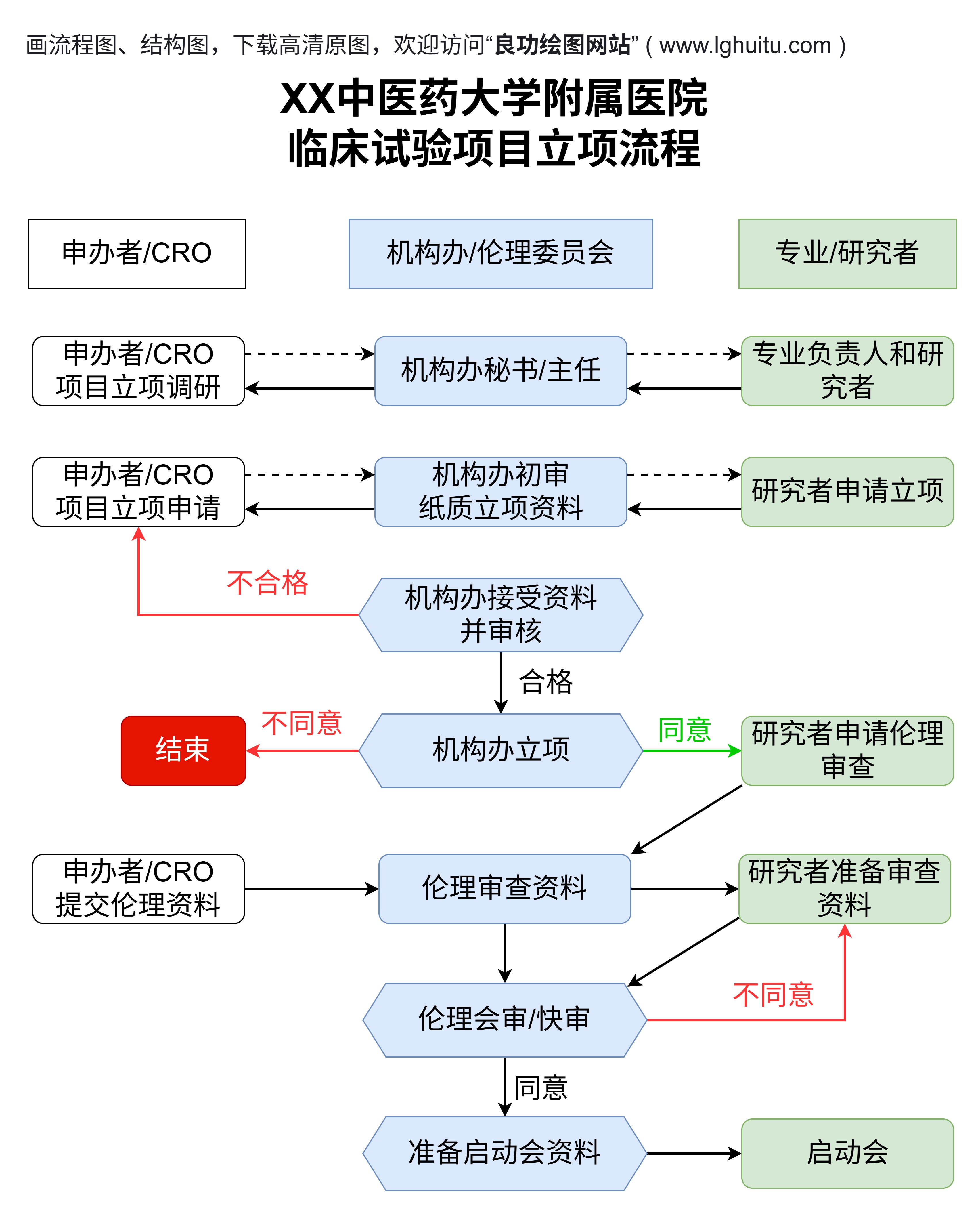
临床试验是药物研发过程中至关重要的一环,它确保了新药的安全性和有效性。在药物进入市场之前,必须经过多个阶段的临床研究。这些研究阶段被分为四个主要阶段:临床试验一期、二期、三期和四期。每个阶段有不同的目标、参与者、研究方法以及评估标准。了解这些阶段的区别,对于理解药物的研发过程至关重要。
临床试验的第一阶段,通常称为一期临床试验,主要目的是评估新药的安全性。此阶段的研究对象通常是健康的志愿者,一般人数较少,通常为20至100人。此时,研究的重点是观察药物在人体中的基本反应,包括药物的吸收、分布、代谢和排泄过程(即ADME),以及药物的安全性和副作用。
一期临床试验还会通过不同的剂量梯度来评估药物的安全范围。研究人员会通过增加剂量来观察是否会出现不良反应,从而确定药物的最大耐受剂量(MTD)。由于此阶段的参与者是健康人群,主要的风险是在于药物对人体可能产生的未知副作用。

当一期临床试验成功完成,并且药物没有显著的不良反应时,药物进入二期临床试验。二期试验的目标是评估药物的疗效。此时,药物将不再仅仅对健康人群进行测试,而是转向目标疾病的患者群体。这一阶段的参与者通常是几十到几百人。

二期试验的核心任务是确认药物是否具有治疗效果,是否能改善患者的病情,或缓解症状。研究人员还会继续监测药物的安全性和耐受性。与一期不同,二期试验开始涉及药物的剂量调整、最佳给药方案以及疗效评估。此阶段的研究可能会发现药物的一些意外疗效或潜在的副作用。

三期临床试验是药物研发过程中最为关键的阶段,也是药物获得批准的最后一道关卡。三期试验的目标是进一步验证药物的疗效和安全性,并在更大范围内进行对比。此阶段的参与者人数通常是几千人,研究的广度和深度远远超过前两个阶段。
三期试验的设计更加严谨和复杂,往往会采取随机对照、双盲等方式,以最大程度地减少偏差。这一阶段会有多个研究中心同时进行,覆盖的患者群体更加广泛,通常包括不同年龄、性别、种族以及伴随其他疾病的患者。因此,三期试验的结果能够更全面地反映药物的真实效果和潜在风险。
在三期临床试验结束后,如果药物的疗效和安全性得到了充分的证实,研究者会向药品监管机构提交相关数据,申请药品的上市批准。
四期临床试验也叫上市后试验,通常发生在药物获得批准并正式上市之后。尽管药物在三期试验中已经经过了大量的验证,但由于三期试验的参与者相对较为有限,且试验时间较短,因此无法涵盖所有的使用场景和潜在的稀有副作用。因此,四期临床试验的核心任务是监控药物在真实世界中的应用效果,进一步评估其长期安全性和有效性。
四期试验的参与者通常是所有实际使用药物的患者群体。此时,药物已经进入市场,患者在医生的指导下使用药物进行治疗。四期临床试验的研究目标可以是药物与其他治疗方法的比较,或是对药物的特定人群使用效果进行评估。
四期临床试验的另一个重要目标是监测药物的长期不良反应。即便是已知的药物,也可能在大规模使用中暴露出新的不良反应,尤其是在特定人群中,或者是长期使用的情况下。因此,四期试验的安全性监测至关重要。
四期研究还可能评估药物的使用方便性、患者依从性等方面。研究人员会评估药物的实际使用效果,以便为患者提供更好的治疗方案,并在市场中保持药物的竞争力。
临床试验的一二三四期各自有其独特的作用和目标。从药物的安全性评估到疗效验证,再到大规模的验证和上市后的监控,每个阶段都为药物的最终上市提供了保障。每个阶段都需要经过严格的科学评估和大量的数据支持,确保药物能够在市场上以安全有效的方式发挥作用。理解这些阶段的区别和意义,不仅能够帮助我们更好地认识药物的研发过程,也能让我们在使用新药时,拥有更大的信心和保障。