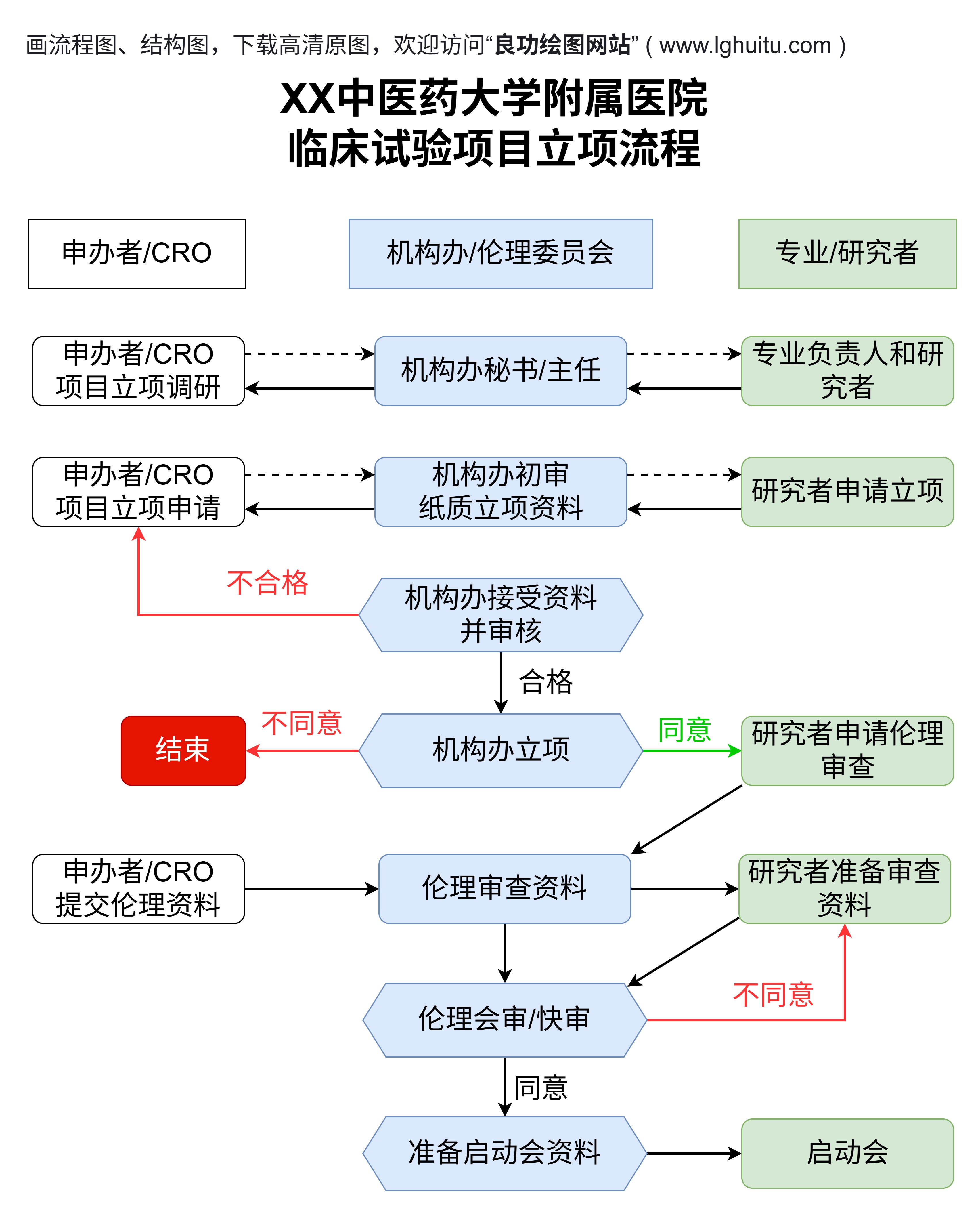
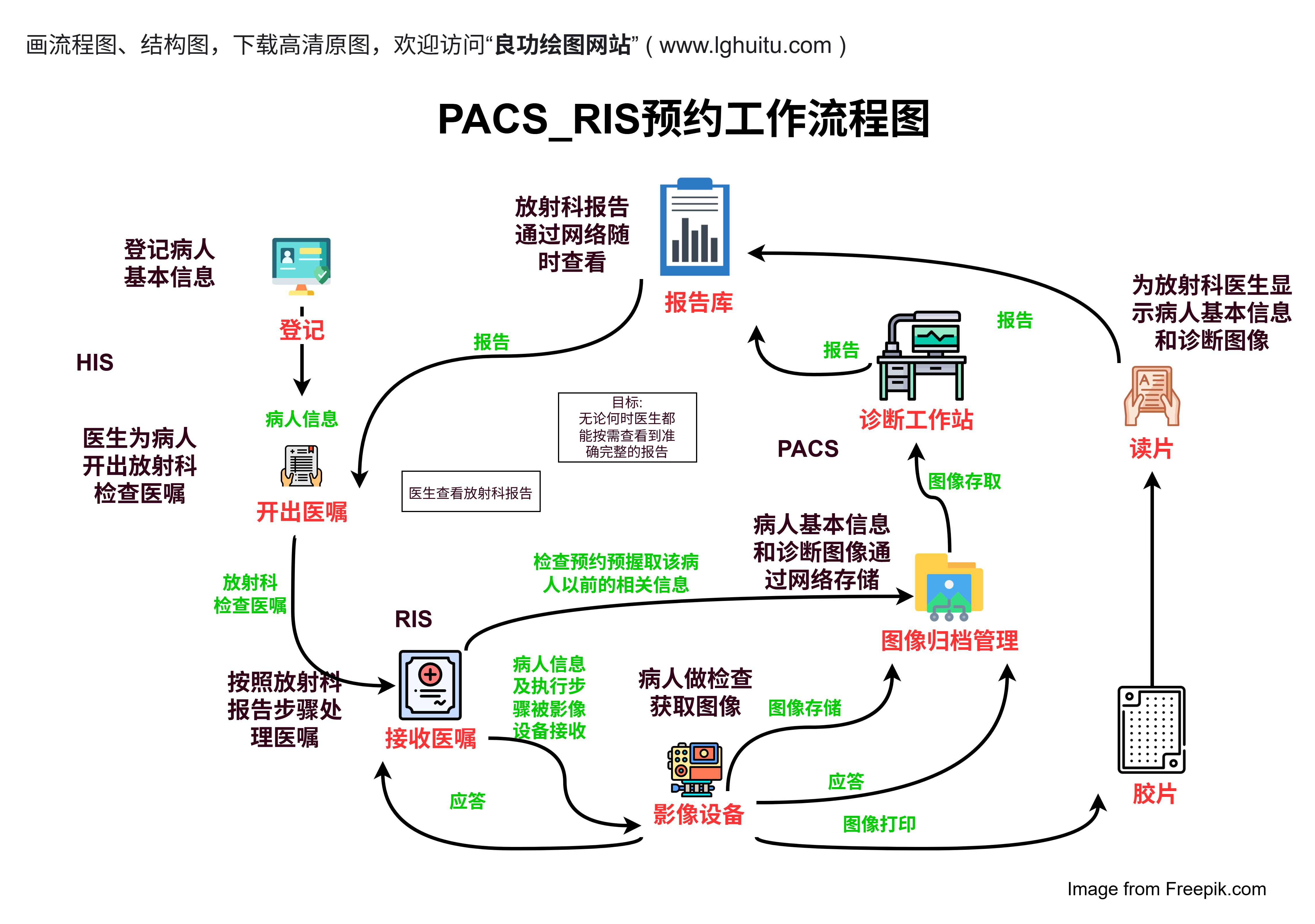
临床试验分几期?每一位关注医疗健康的人,或许都曾听说过这个问题。临床试验是医药研发中的关键步骤,涉及到药物、疫苗或新疗法的安全性和有效性的验证。临床试验究竟分为哪些阶段?每个阶段的目的和内容是什么?今天我们就带您深入了解临床试验的不同阶段,帮助您更好地理解这一过程背后的重要性和科学性。
临床试验的第一期通常被称为“第一阶段临床试验”,其主要目的是评估新药的安全性和耐受性。在这个阶段,研究人员会选择少数健康志愿者进行测试。由于新药还没有经过人体试验,研究人员需要关注的重点是药物是否会引起不良反应,是否能在人体内正常代谢,并且评估药物的剂量范围。
第一期临床试验一般不会涉及到疾病患者,研究的主要对象是健康成人。这一阶段通常会使用极小的剂量,并逐渐增加剂量,以观察人体对药物的反应。在此过程中,研究人员会密切监控每位参与者的反应,以确保药物不会对身体造成严重损害。

虽然这一阶段看起来主要集中在药物的安全性,但它对药物研发的意义重大。无论药物是否进入下一阶段,第一期的试验结果都将为未来的临床研究提供至关重要的数据。
第二期临床试验的主要目标是评估药物的疗效,确定其是否能够有效治疗特定的疾病。在这一阶段,研究人员将开始测试药物对患者的实际效果。与第一期不同,第二期的参与者不再是健康志愿者,而是已经患有相关疾病的患者。

第二期临床试验往往是一个小规模的试验,参与者的数量一般在数十人到一百人之间。在这一阶段,研究者会重点观察药物的效果以及剂量的优化。通常,第二期的试验会通过不同的剂量组合来确定最佳治疗剂量,并监测药物的副作用。

需要注意的是,第二期试验并不一定能够立即证明药物的疗效,但它能够提供足够的数据,帮助研发团队决定是否推进到下一阶段的更大规模临床试验。
如果药物在前两个阶段的试验中都显示出良好的安全性和疗效,那么它将进入第三期临床试验。第三期是临床试验的关键阶段,目标是验证药物在更大范围内的疗效和安全性,确保其对广泛患者群体的适用性。
第三期临床试验通常会包括几百甚至几千名患者,试验的设计也更加严谨和复杂。研究人员会采用随机对照试验(RCT)设计,以最大程度地排除外部因素的干扰,确保试验结果的准确性和可靠性。在这一阶段,研究人员将详细记录药物的效果、副作用以及与其他治疗方法的比较,最终帮助监管机构评估药物是否符合上市标准。
与前两个阶段不同,第三期试验的数据将直接影响药物的审批进程。如果药物在这一阶段表现出明显的疗效并且副作用在可接受范围内,它就有可能获得监管机构的批准,进入市场。
临床试验的第四期,又称为“上市后监测”,是指药物上市之后,研究人员继续进行的临床研究。第四期的主要目的是监测药物在长期使用中的效果和安全性。这一阶段的临床试验通常涉及到更多的患者和更长的观察时间,重点是监测药物在实际应用中的长期效果,特别是对某些罕见副作用的观察。
由于临床试验的前三个阶段通常涉及的患者群体较为有限,第四期临床试验则是对药物在更广泛人群中的验证。这一阶段可以揭示药物在特定人群(如老年人、孕妇或儿童)中的安全性,也能帮助发现药物在长期使用过程中可能出现的新副作用。
第四期临床试验对药物的上市后监管至关重要。监管机构会密切关注这一阶段的研究结果,以确保药物的安全性不会因长时间使用而出现问题。如果在第四期临床试验中发现药物存在严重副作用,可能会导致药物被撤市或调整使用建议。
临床试验的每一阶段都起着不可或缺的作用。通过严格的科学实验,临床试验确保了新药物、新疗法的安全性和有效性,为全球患者提供了更好的治疗选择。从药物的研发到最终的市场投放,临床试验每一步的严谨性和细致性都不可忽视。
可以说,临床试验不仅仅是药物研发的一个步骤,更是医学进步的推动力。每一次成功的临床试验,都可能意味着一种新治疗方案的诞生,为患者带来新的希望。随着医学科学的不断进步,我们可以期待未来更多的突破,而这些突破背后,都离不开临床试验的支持。
临床试验分为四个主要阶段,每个阶段的目的和意义各不相同。无论是药物的安全性、疗效,还是对患者的长远影响,临床试验都为我们提供了科学的依据,推动了医学的不断发展。了解这些阶段,也能让我们更加信任科学进步的力量,期待未来更多的健康突破。