在药物研发和医疗领域,临床试验报告(ClinicalTrialReport,CTR)作为一种系统性的科学文献,起着至关重要的作用。它不仅是对临床试验的总结,也为下一步的科学研究、药品审批、甚至是临床实践提供了宝贵的参考依据。通过临床试验报告,我们能够全面了解一个药物、治疗方法或医疗设备在不同人群中的有效性、安全性和适用性。临床试验报告到底包括哪些重要内容呢?

每一份临床试验报告的开篇都会详细列出试验的基本信息,包括但不限于试验名称、试验的编号、执行机构、试验地点、伦理委员会的批准情况等。这些信息的完整性和准确性,能够让阅读者对试验的背景有一个清晰的认识,并确保其具有合法性和伦理依据。

研究背景部分通常会介绍药物或治疗方法的研发背景、已有研究成果和市场需求。这一部分的目的是为试验的开展提供科学依据,阐明为何需要进行该临床试验,并解释试验的主要目标。这些内容对于理解试验的必要性及其对患者和社会的潜在影响至关重要。

试验设计部分是临床试验报告中的核心部分,它详细阐述了试验的整体方案。具体包括:
研究类型:是随机对照试验、开放标签试验还是盲法试验?
受试者选择标准:包括纳入标准和排除标准,明确哪些患者适合参加本次试验。
结局指标:试验的主要终点和次要终点,例如疗效评估、安全性评估等。
这一部分的内容为后续的数据分析和结论提供了科学依据,帮助确保试验的科学性和可重复性。
试验结果部分是临床试验报告的重中之重。它通常包括以下几个方面:
患者基线特征:包括性别、年龄、病史等信息,帮助评估受试者的代表性和试验结果的适用性。
疗效数据:详细列出干预组和对照组的治疗效果对比,通常采用统计学方法来验证干预措施是否显著改善了患者的健康状况。
安全性数据:列出试验中出现的不良反应、严重不良事件及其发生频率,评估药物或治疗方法的安全性。
统计分析:包括P值、置信区间等,帮助评估结果的显著性和可靠性。
这些数据对于评估药物的临床应用价值至关重要,也是药品审批的基础。
在讨论部分,研究人员会对试验结果进行深度分析,结合现有文献和研究数据,探讨结果的临床意义、局限性和可能的解释。也会考虑试验设计中的不足之处和未来研究的方向。结论部分则会对试验的总体结果进行总结,明确药物或治疗方法是否达到了预期目标,并指出其在临床应用中的潜力。
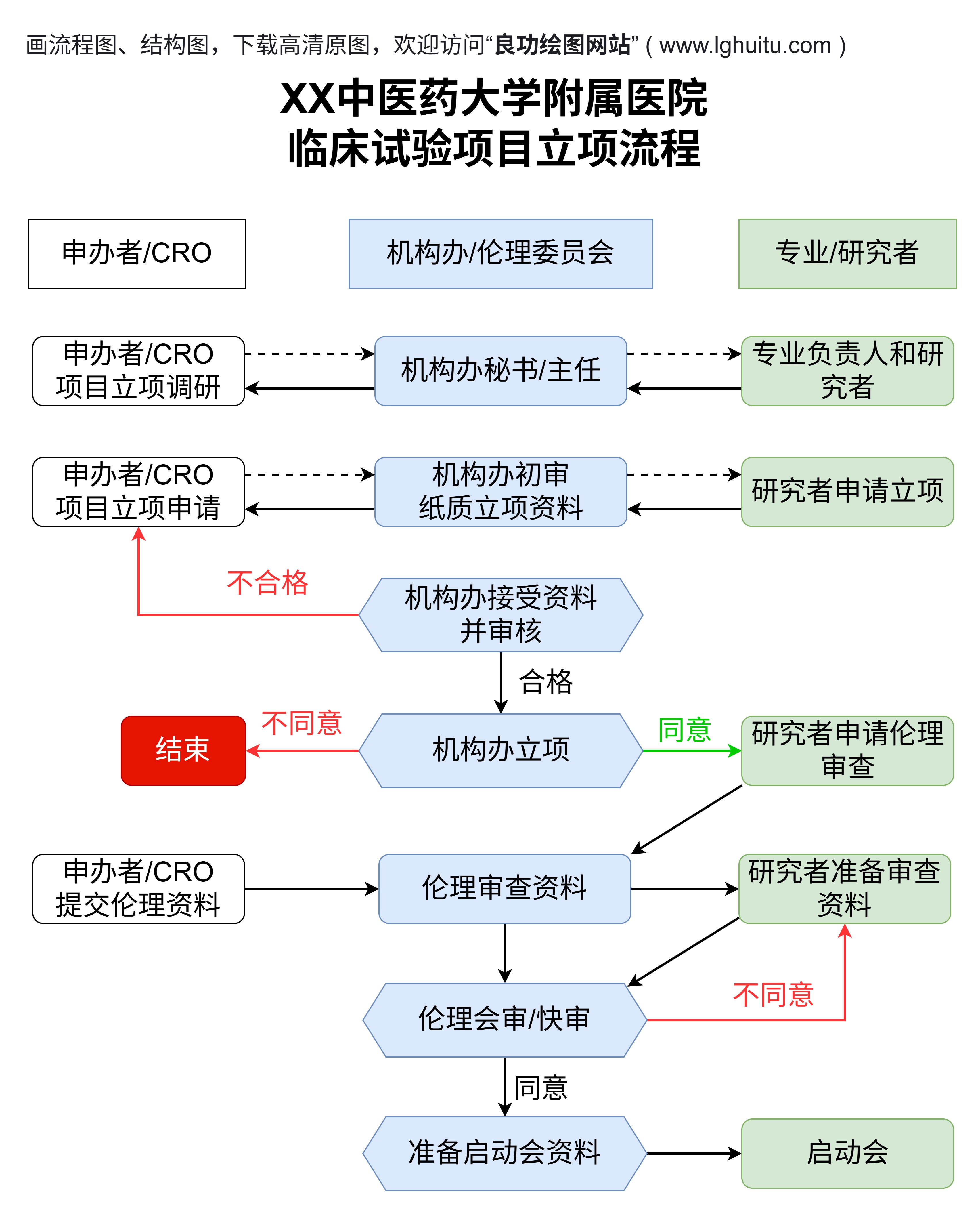
临床试验报告中的伦理部分是不可或缺的。试验的设计、执行和数据分析都必须遵循伦理原则,保证受试者的知情同意和隐私保护。报告中会详细说明试验遵循的伦理规范,如是否获得伦理委员会批准,是否遵循《赫尔辛基宣言》等国际伦理标准。还会披露任何潜在的利益冲突,确保研究的独立性和公正性。
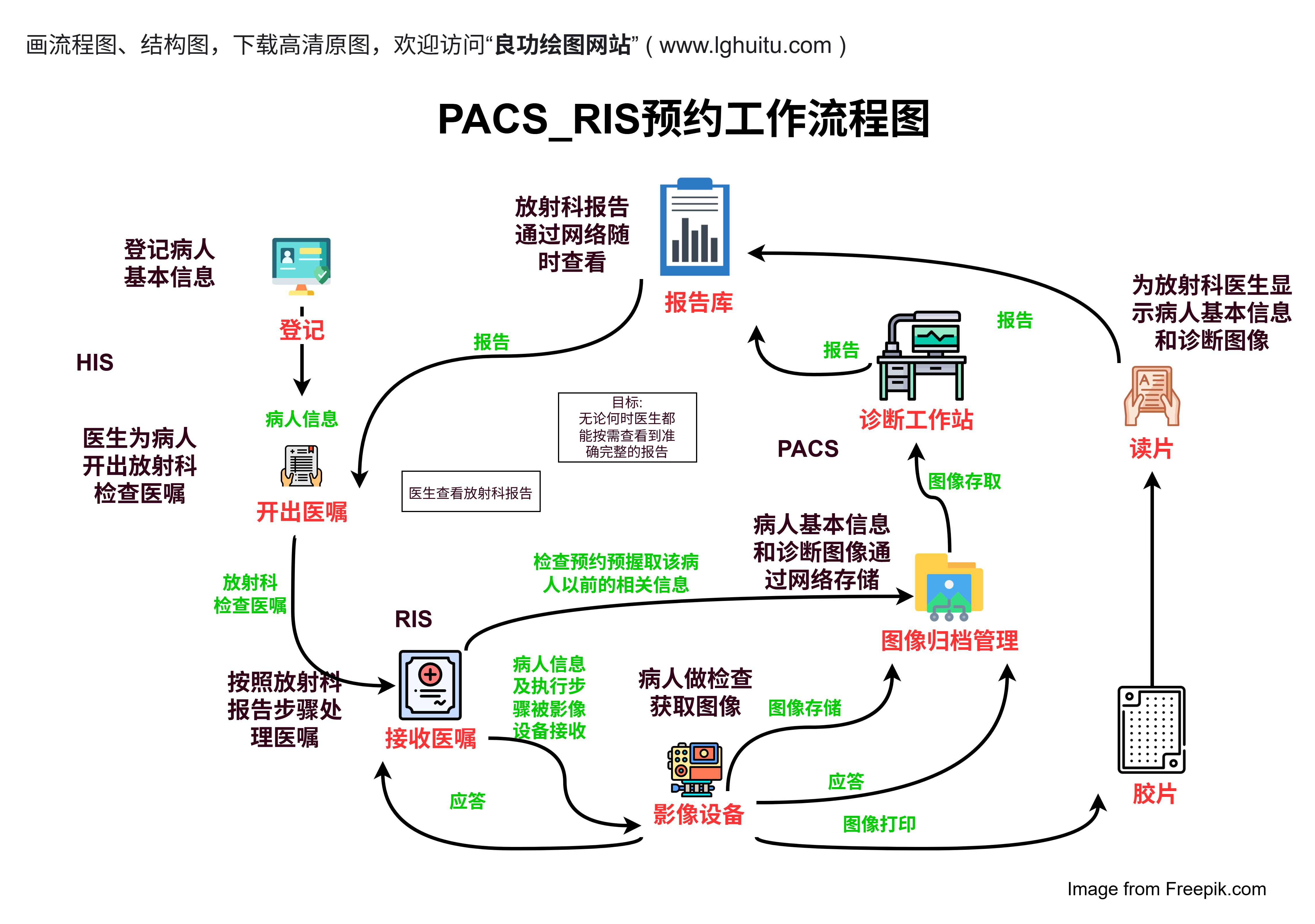
在一些复杂的临床试验中,报告还会附带数据补充文件、表格或其他附件。这些附件可以包括详细的统计分析、子组分析结果、随访数据等,帮助阅读者更加深入地理解试验过程和结果。对于科研人员来说,附加数据是验证试验结论和探索新问题的重要资源。
临床试验报告不仅是科研人员的内部参考文件,它还需要通过学术期刊、政府审批机构等渠道对外发布。药品审批、医疗器械注册等过程通常依赖于这些报告的结果,决定是否批准上市。在一些国家和地区,临床试验报告还需要通过临床试验登记平台进行公开,以保证透明度和公信力。
随着临床研究的不断发展,现代临床试验报告面临着许多挑战。一方面,试验的设计越来越复杂,需要涉及的领域和学科越来越广泛;另一方面,试验结果的解读也变得更加多样化和精细化。随着大数据和人工智能的发展,未来的临床试验报告可能会结合更多的数据分析技术,以更高效、更精确地呈现试验结果。
临床试验报告不仅仅是一个简单的数据总结,它凝结了试验设计、数据分析、伦理审查等多方面的内容。通过科学、详细的报告,我们能够更好地评估新药或治疗方法的效果与安全性,也为未来的科研人员提供了重要的参考和借鉴。对于每一位从事医学研究、药物研发的专业人士而言,理解临床试验报告的关键内容,并能准确解读其中的数据和结论,无疑是提升自身研究水平的重要一步。