在当今医学研究领域,临床试验是新药物、新治疗方法及医疗器械的重要验证步骤。为了确保这些试验的科学性与透明性,全球范围内的临床试验都要求进行注册。临床试验注册中心(ClinicalTrialRegistry)便是实现这一目标的重要平台。它不仅能够确保研究的公开性和透明性,还能够为患者、医生和研究者提供可信赖的信息来源。

临床试验注册对于医学研究的意义不言而喻。临床试验注册有助于确保科学研究的完整性。通过注册,所有临床试验的设计、方法以及结果都能被记录和追溯,避免了研究结果的选择性报告。更重要的是,试验注册能有效防止试验数据的“篡改”和“隐瞒”,从而保证医学研究的公正性。

临床试验注册为患者提供了更多的选择和保障。当一项临床试验被公开注册后,患者可以更方便地了解到当前有哪些新的治疗方案可以尝试,哪些试验正在进行中,以及这些试验的风险与潜在收益。注册中心也会对试验过程中的伦理问题进行监督,确保患者的安全与权益得到保障。

临床试验注册中心不仅是一个信息存储的平台,它还具有多重功能。中心提供了一个标准化的注册流程,确保所有的临床试验都按照相同的规范进行登记。这种标准化不仅提升了试验的可信度,也方便了跨国研究的比较和数据整合。
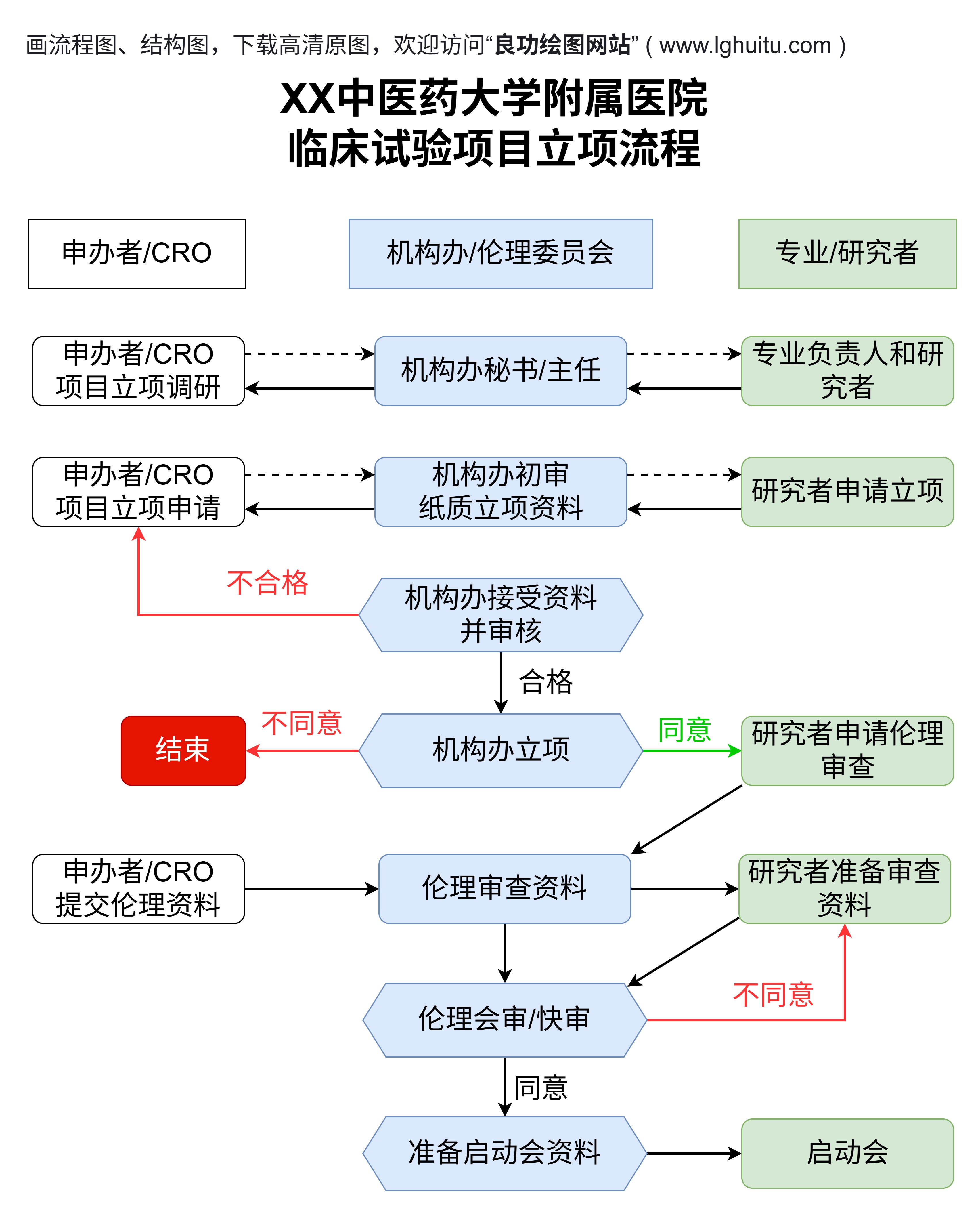
注册中心还充当着全球科研合作的重要纽带。许多跨国制药公司和科研机构在进行临床试验时,会通过注册中心共享研究数据与试验结果。这不仅推动了全球医学研究的互通性,还促进了国际间的合作与知识共享。
更为关键的是,临床试验注册中心的存在为政策监管提供了强有力的支持。政府相关部门可以通过中心的注册信息,掌握当前药物研发的最新动态,从而出台更加精准的监管政策。而研究人员也能借此获得最新的法规与规范,确保试验的合规性和科学性。
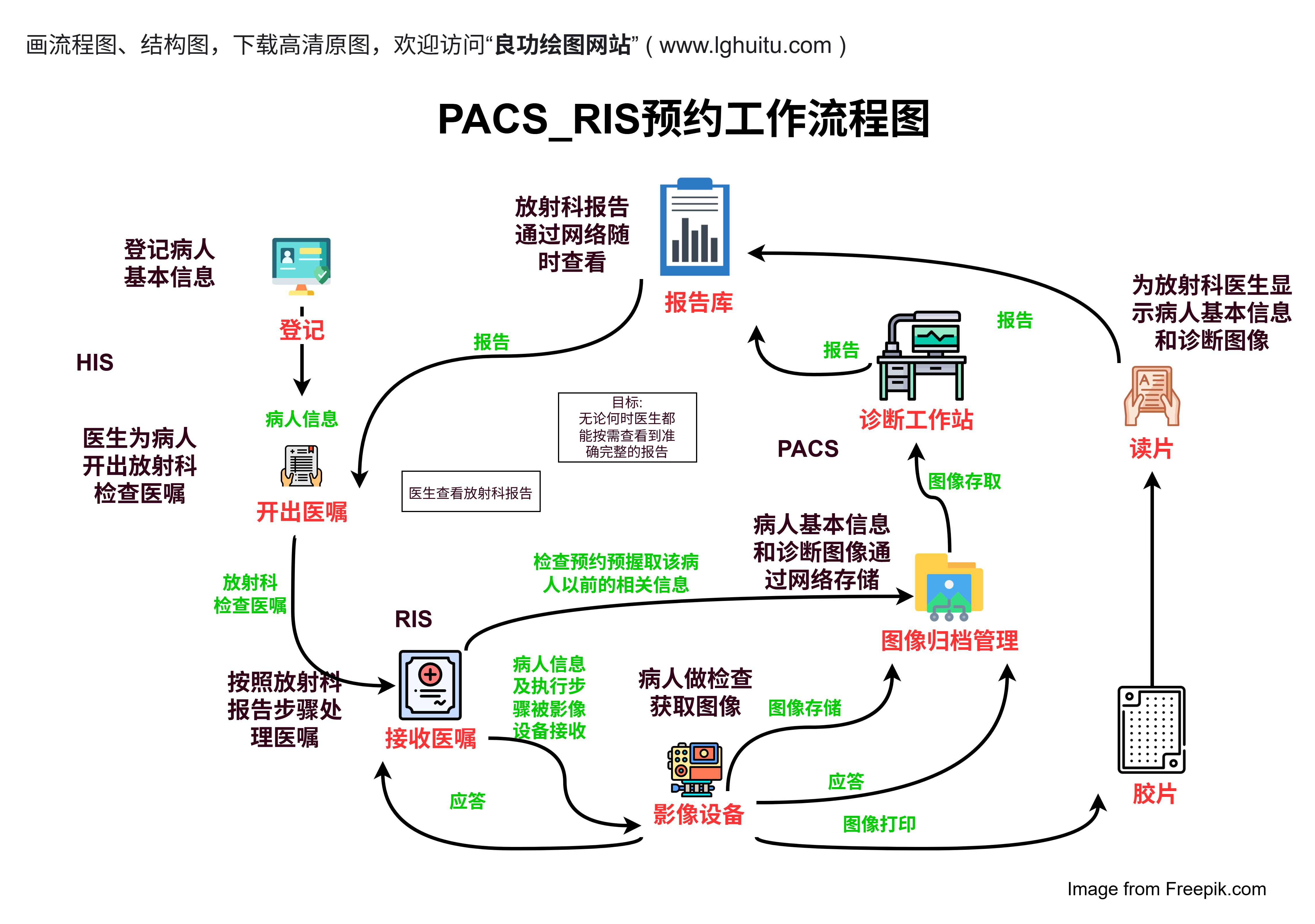
随着新药研发的不断进展,临床试验在药物上市过程中的重要性愈加突出。临床试验注册中心为新药研发提供了坚实的基础。通过注册,药物研发的每一个环节都能得到详细记录,试验中的每一项数据都能得以追溯。这种科学性和透明性的保障,不仅能够提升公众对新药的信任度,还能够帮助制药公司避免试验中的不必要风险。
注册中心还能够汇聚来自全球的试验数据。通过对这些数据的综合分析,研究人员可以更快地识别药物研发过程中的潜在问题,进而优化药物的设计和疗效评估。这对于加速新药的上市、提高药物的安全性和疗效具有重要的推动作用。
近年来,随着全球医学研究和制药行业的快速发展,临床试验注册也在不断地发展和完善。世界卫生组织(WHO)及多个国际医学组织对临床试验注册的规范和要求不断提出新的标准,推动全球范围内的注册系统建设。
在很多发达国家,临床试验注册已经成为药物研发和上市的必备环节。例如,美国的临床试验注册系统(ClinicalTrials.gov)以及欧盟的临床试验注册平台,已成为全球公认的重要数据库。这些平台不仅提供了大量的临床试验信息,也为科研人员、医生、患者和公众提供了便捷的查询服务。
随着全球对临床试验透明度的要求日益增加,越来越多的国家和地区开始建立和完善自己的注册系统。我国在近年来也逐步加强了临床试验注册的管理力度,许多试验已纳入国家药品监督管理局(NMPA)的监管范畴。国内的临床试验注册平台已经成为医学研究和药品监管的重要组成部分,为我国的药物研发提供了强大的支持。
临床试验的最终目的是改善患者的健康状况,因此,患者的权益保障是临床试验注册中的核心要素之一。注册中心通过确保试验的伦理合规性,保护患者免受潜在的试验风险。每个注册的临床试验都必须进行伦理审查,并告知参与者试验的潜在风险与收益。这种透明度确保了患者在参与试验前可以做出知情选择。
注册平台也提供了试验结果的公示机制。无论试验结果是否符合预期,都必须在注册平台上公开。这样的做法不仅让患者可以了解试验的最终效果,还促进了研究者之间的相互监督,推动了研究的科学性与公正性。
未来,临床试验注册中心将在全球范围内发挥越来越重要的作用。随着大数据、人工智能等技术的不断进步,注册中心将能够更高效地处理和分析全球范围内的试验数据。数据共享和信息透明将更加便捷,为全球医疗健康事业提供更强大的支持。
在新的科技变革中,临床试验注册中心将不仅仅是一个信息存储的平台,更是一个动态、智能的数据分析和决策支持中心。通过更加高效的数据处理与智能化的分析手段,注册平台将为研究人员、患者和政策制定者提供更加精准的决策依据,助力全球医疗健康领域的发展。
临床试验注册中心是医学研究不可或缺的一部分,它为新药研发、患者保护、科研透明和国际合作提供了强大的支持。随着全球医疗健康事业的不断发展,注册中心将在促进科学进步和保障公众健康方面发挥越来越大的作用。