在当今医学发展飞速的时代,药物的研发对于人类健康至关重要。药物临床试验作为药物研发过程中的核心步骤之一,不仅为药物是否能上市提供了科学依据,也对确保药物安全性和有效性起到了至关重要的作用。药物临床试验究竟是怎样的一项工作呢?它又是如何确保我们所使用的药物是安全的呢?

药物临床试验的核心目标是验证药物的安全性和有效性。具体来说,这项工作包括四个主要阶段,分别是Ⅰ期临床试验、Ⅱ期临床试验、Ⅲ期临床试验和Ⅳ期临床试验。每一阶段的目的、参与者以及研究内容都有所不同,这也使得药物研发的全过程呈现出多维度的科学探索。

Ⅰ期临床试验通常是药物进入临床研究的第一步,参与者一般为健康志愿者。通过这一阶段的研究,科研人员首先关注药物对人体的基本反应,主要目的是评估药物的安全性、剂量范围和药物代谢。由于这个阶段没有治疗疾病的目的,因此测试的样本量较小,试验对象一般在20到100人之间。
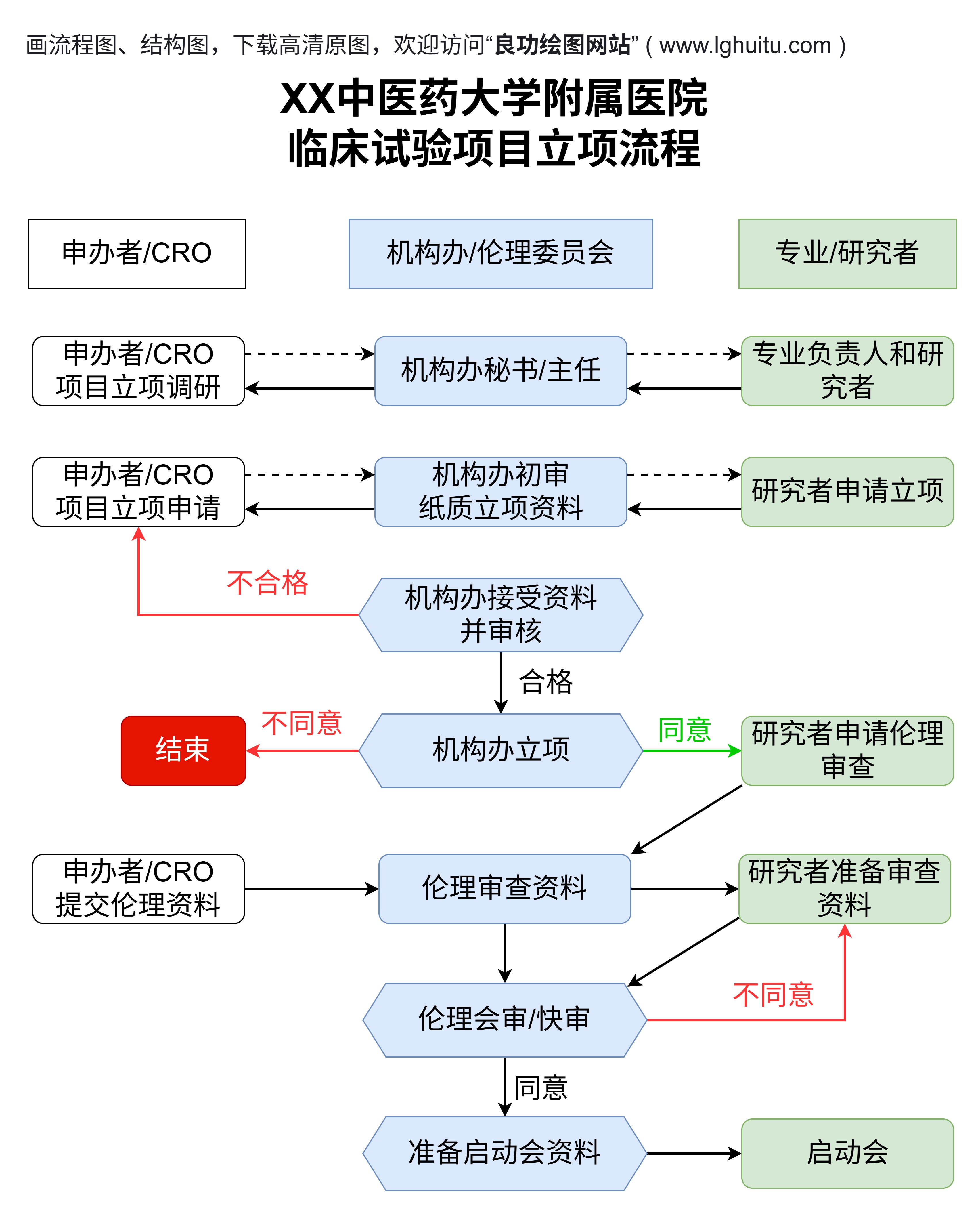
这一阶段的临床试验至关重要,因为它帮助研发团队了解药物的基本药理学特性,包括药物在人体内的吸收、分布、代谢和排泄情况。通过这些数据,研究人员能够判断药物是否适合进入后续的更大规模试验。
经过Ⅰ期的安全性验证后,药物进入Ⅱ期临床试验。在这一阶段,研究对象通常是患有特定疾病的患者,而不再是健康志愿者。Ⅱ期临床试验的主要目的是评估药物对目标疾病的疗效以及进一步确认药物的安全性。相比Ⅰ期,Ⅱ期试验的样本量较大,通常为100到300人。
在Ⅱ期,科研人员通过对比实验组和对照组的疗效差异,分析药物是否能够真正达到预期的治疗效果。如果药物在此阶段表现出较好的疗效和可接受的副作用,便可以进入更为严格的Ⅲ期临床试验。需要特别强调的是,Ⅱ期不仅仅是为了验证疗效,更重要的是通过这一阶段确认药物的最佳剂量和给药方案。

Ⅲ期临床试验通常是药物研发过程中的关键一环,也是药物能否获得上市许可的重要指标。这一阶段的研究通常是在多中心、大规模的人群中进行,样本量可达几百人甚至几千人。此阶段的目标是进一步验证药物的疗效和安全性,确保药物在广泛人群中的效果和风险处于可接受范围内。
Ⅲ期临床试验通常采取随机对照试验(RCT)设计,这是目前验证药物疗效的金标准。通过对比实验组和对照组的疗效和副作用,科研人员能够全面评估药物的整体表现。在通过这一阶段的临床试验后,药物才有可能获得批准进入市场,供广大患者使用。
药物经过Ⅰ、Ⅱ、Ⅲ期临床试验的验证,最终获得市场批准。药物的临床研究并不会因此结束,Ⅳ期临床试验作为药物上市后的持续观察阶段,依然在药物生命周期中占据着重要位置。
Ⅳ期临床试验是药物上市后进行的长期研究,目的是对药物在更大范围内的应用效果进行观察和评估。通过这一阶段的研究,科研人员可以收集到大量来自实际使用中的数据,从而更好地了解药物在长期使用过程中可能出现的新问题,如稀有副作用、长期疗效等。
例如,某些药物可能在临床试验时未能发现的稀有副作用,在广泛使用后可能会暴露出来。Ⅳ期临床试验因此成为药物上市后的重要“监测”环节,对确保药物的持续安全性和有效性具有重要意义。
药物临床试验虽然是现代药物研发中不可或缺的一部分,但也面临着诸多挑战。药物研发的周期较长,尤其是Ⅲ期临床试验,通常需要数年的时间才能完成;药物的临床试验涉及大量的伦理和法律问题,尤其是涉及患者时,如何平衡药物的潜在风险和其治疗价值,是研发团队必须面对的重要问题。
未来,随着科学技术的不断发展,药物临床试验有望实现更高效、更精准的进展。例如,个性化医学的兴起,可能使得药物的研发更加精准,临床试验中的受试者群体也可以根据基因特征进行更细致的划分,从而提高试验结果的可信度和有效性。
总体来看,药物临床试验是一个复杂而严谨的过程,它涉及从药物安全性、有效性到市场接受度的全方位评估。通过每一阶段的严谨研究,药物的研发才能最终造福患者,推动人类医学的进步。